温度是进化的重要驱动力之一。随着温度的升高,酶的催化活性会相应的提高,但与此同时,酶与底物之间的亲和力会下降。因此,在高温适应的过程中,只提高热稳定性是不够的,酶可能会遇到底物亲和力太弱的问题。金属离子能够增强金属酶的活性、稳定性和底物亲和力,但是金属离子螯合氨基酸在高温适应性过程的作用尚不明确。近日,青岛能源所微生物资源团队针对多糖裂解酶高温适应性的相关研究结果证明金属离子螯合氨基酸在酶的高温适应过程中提高底物亲和力的功能,相关成果发表在FEBS Letter 杂志(DOI: 10.1002/1873-3468.12965)。
Defluviitalea phaphyphila是课题组从青岛沿海沉积物中分离得到的一株嗜热厌氧细菌,该菌株具有强大的多糖裂解酶体系,能够直接转化褐藻中的海藻酸钠等多糖,产生乙醇。研究人员首先对来自D. phaphyphila 的其中一个钙离子依赖型海藻酸钠裂解酶 AlgAT0进行了详细的酶学研究。研究表明,结合钙离子时,AlgAT0最适温度为75 ,半衰期长达4.5小时。而目前已有报道中,热稳定性最好的海藻酸钠裂解酶是来自 Nitratiruptor sp. SB115-2的裂解酶rNitAly,但它在67 下的半衰期只有30分钟。
在此基础上,课题组研究了钙离子螯合氨基酸对AlgAT0高温适应性的影响。蛋白序列对比发现,AlgAT0用一个天冬氨酸替换了第238位的谷氨酸(图1)。既然天冬氨酸三个基团的解离常数都小于谷氨酸,所以研究人员大胆猜测,第238位的氨基酸替换很可能增强了酶对钙离子的螯合力。通过等温滴定量热仪(ITC)的实验,研究人员发现 AlgAT0对钙离子的亲和力确实强于突变体D238E。进一步的酶动力学研究发现,突变体D238E的底物亲和力发生下降,最适温度也相应的下降,但是热稳定性却变化不大。这表明AlgAT0通过第238位天冬氨酸对谷氨酸的替换来增强钙离子亲和力,并进一步的增强底物亲和力,以此来适应高温环境。该研究不仅从新的视角揭示了耐高温酶的高温适应性机制,还为耐高温酶的定向改造提供了新思路。
上述研究获得了国家自然科学基金、山东省自然科学杰出青年基金以及青岛市基础研究项目的支持。(文/图 王兵 马小清)
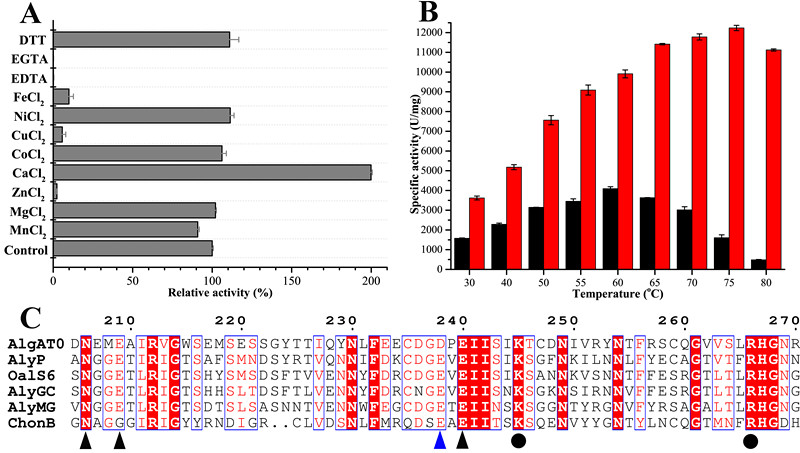
图1,A,不同离子AlgAT0活性的影响。B,钙离子提高AlgAT0最适温度。红色,钙离子存在。黑色,无钙离子。C,部分蛋白序列对比图。AlgAT0替换第238位钙离子螯合氨基酸(蓝色三角形标示)。三角形指示钙离子螯合氨基酸,圆形指示催化氨基酸。